Прорывное развитие в сфере цифровых и биотехнологий, стремительное развитие медицинской науки привело к небывалому качественному росту фармацевтического производства. Чем больше инноваций — тем больше запрос на клинические исследования, как того требует культура доказательной медицины. В статье описаны этапы становления принципов клинических исследований в их современной форме и глобальные тренды, которые отчетливо прослеживаются в этой инновационной сфере сегодня и будут определять ее развитие в перспективе.
Истоки и традиции
Рациональность, убедительность и прозрачность клинических исследований в том или ином виде была очевидна с древнейших времен. Инициатором первого зафиксированного в истории «клинического исследования» был Даниил, который рекомендовал сравнить две группы молодых людей, одна из которых в течение 10 дней питалась бы исключительно растительной пищей, а другая — «царскою пищей», включая мясо1. Происходило это при дворе Навуходоносора, и потребности в дополнительных инструментальных и лабораторных исследований не возникло, на основе визуального осмотра и простого наблюдения было установлено, что молодые люди на вегетарианской диете оказались в более выигрышном положении. Кстати, по этой вечно дискуссионной теме по сей день публикуются ежегодно сотни исследований, большая часть из которых по-прежнему прямо или косвенно подтверждает результаты древнего эксперимента.
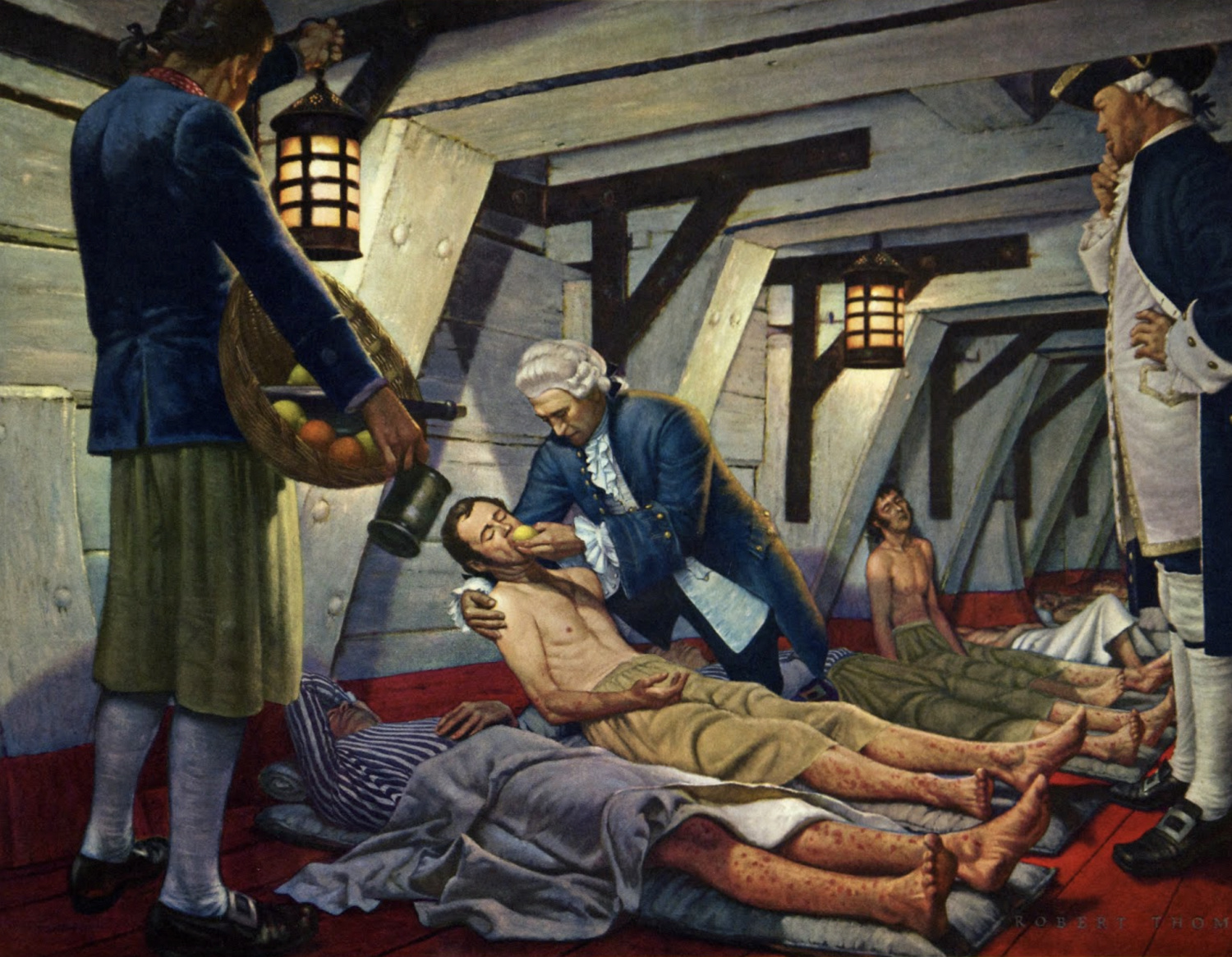
Но основателем традиции клинических исследований считается не ветхозаветный пророк, а британский корабельный врач Джеймс Линд. Его первое в истории контролируемое исследование стартовало 20 мая 1747 года на фрегате «Солсбери». Задачей главного исследователя было выявить наиболее благоприятную диету для избавления матросов от цинги. Первый врач-исследователь разделил заболевших на шесть групп, каждая из которых в дополнение к обычному рациону получала те или иные продукты в определенном количестве. Неожиданную для самого доктора эффективность показал ежедневный прием одного лимона и двух апельсинов в дополнение к обычному рациону питания. Участникам этой группы повезло больше всех. Остальные гипотезы врача (сидр, разведенная серная кислота, мускатный орех, морская вода, уксус в качестве добавок к пище) не подтвердились и были отброшены. С тех пор 20 мая отмечается как Международный день клинических исследований. А Британская империя, отчасти благодаря открытию доктора Линда и лимонам, смогла стать крупнейшим колониальным проектом в истории. Сохранилось подробное описание исследования, позднее опубликованное доктором Линдом.
Спустя полвека было задокументировано понятие плацебо, которое затем стало неотъемлемой частью самой концепции современных клинических исследований. Роберт Хупер ввел его в обиход в медицинском словаре 1811 года: «”Сделаю приятно”: эпитет для любого лекарства, применяемого скорее с целью угодить пациенту, а не принести ему пользу»2.ПО ДАННЫМ НА 14 НОЯБРЯ 2023 ГОДА, В МИРЕ ПРОХОДИТ 473 000 КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
Впрочем, феномен плацебо оказался не столь однозначным и по сей день вызывает колоссальный научный интерес, ему посвящено множество серьезных клинических исследований. Но первое плацебо-контролируемое клиническое исследование состоялось спустя еще полвека, в 1863 году, когда было доказано, что эффективность любых существующих на тот момент лекарств от ревматизма равна нулю и полное отсутствие лечения приносит такой же результат.
Спустя еще полвека на первый план стали выходить вопросы безопасности лекарственных средств. Бурное и бесконтрольное развитие фармацевтики требовало создания надзорных органов и предоставления доказательств безопасности того или иного средства. В 1906 году в США был принят «Акт о чистоте пищевых и лекарственных продуктов». А еще спустя два десятка лет появилась организация, на которую был возложен контроль безопасности буквально всего выходящего на широкий рынок — Food and Drug Administration, FDA (Управление по контролю за продуктами и лекарствами), на чьи строгие стандарты оглядываются сегодня производители фармацевтических препаратов и медицинских изделий всего мира.
Середина ХХ века была особенно насыщенной в истории клинических исследований. В годы Второй мировой войны, 1939–1945, в Великобритании было задокументировано первое двойное слепое контролируемое исследование с участием тысячи человек3. И хотя результат разочаровал авторов исследования (изучалась эффективность микотоксина патулина при простуде), это был важный шаг в развитии принципов клинического исследования.
В 1946–1947 годах состоялось первое рандомизированное исследование, посвященное изучению эффективности стрептомицина для больных туберкулезом легких. Была продумана система включения или невключения пациентов, четкие критерии рандомизации. Поскольку стрептомицина все равно не хватило бы на всех, этический вопрос для организаторов исследования был не актуален.
Вопросы этичности ознаменовали следующий этап развития в сфере клинических исследований. Вехой в истории медицинской науки стал Нюрнбергский кодекс, принятый сразу по завершении Нюрнбергского процесса и напрямую с ним связанный. Он закрепил принципы добровольности участия в любых исследованиях и другие этические аспекты исследований на людях.
В 1964 году Всемирной медицинской ассоциацией была принята Хельсинкская декларация, в которой более развернуто прописаны принципы проведения клинических исследований с точки зрения этики и безопасности. Декларация обновляется каждые несколько лет с учетом нового опыта. В текущую версию вносились изменения в 2013 году4.
Несмотря на непростые времена и трагические страницы в истории клинических исследований, наука извлекает уроки из прошлого и уверенно смотрит в будущее. Сегодня благодаря цифровым технологиям, активно вошедшим в нашу жизнь на рубеже веков, созданы новые возможности для проведения синхронных многоцентровых исследований по всему миру, что повышает их точность и клиническую значимость. Работа с большими данными, телемедицина, интернет вещей — эти технологии будущего уже сегодня становятся трендами в развитии клинических исследований.
Актуальная картина
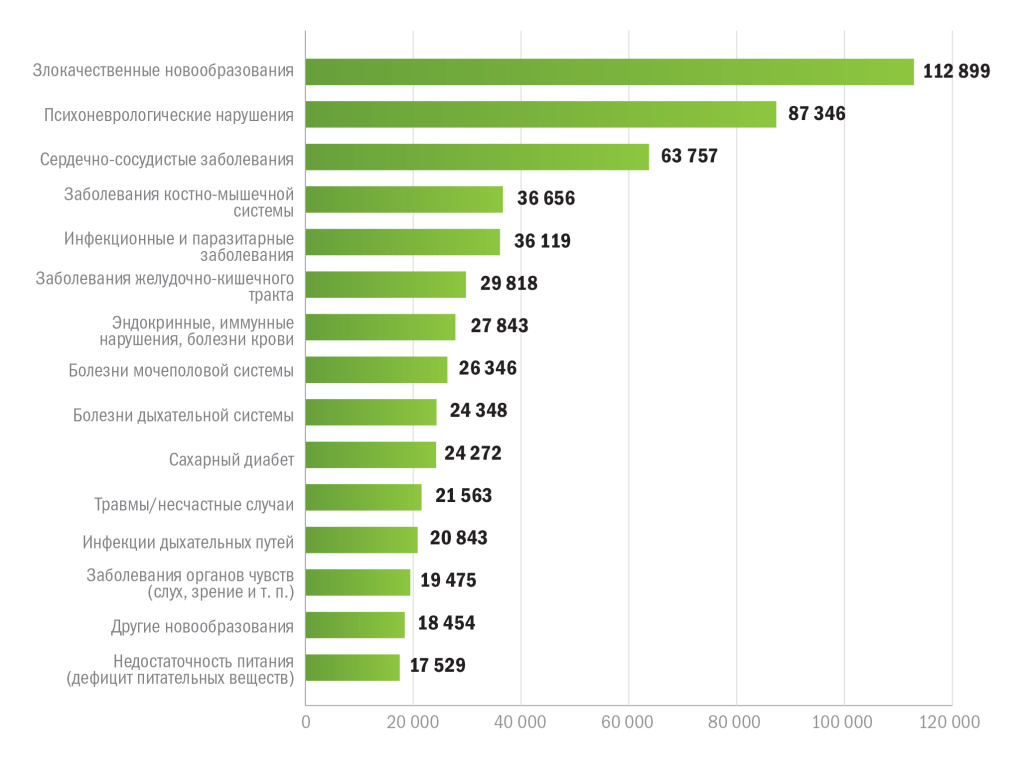
Клинические исследования — дорогостоящее дело, и в среднем стадия разработки занимает 16 лет. Из 5–10 тысяч молекул-кандидатов, которые проходят скрининг, лишь 2–5 % доходят до стадий лабораторных испытаний. 250 молекул доходят до этапа преклинического исследования на лабораторных животных, а до этапа клинического исследования — лишь 5 молекул, из которых в результате остается только одна. Наибольшее число исследований уже многие десятилетия нацелены на поиск средств для лечения от рака. На втором месте — сфера психоневрологии, наибольший интерес направлен на поиск возможностей лечения болезни Альцгеймера, различных форм деменции, что объяснимо ростом продолжительности жизни и общей озабоченностью завтрашним днем стареющего человечества. Третье место занимают средства против сердечно-сосудистых заболеваний5. Значительный всплеск исследований в сфере инфекционных заболеваний, поднявших число исследований в этом направлении на пятую строчку рейтинга, связан, очевидно, с пандемией COVID-19 и стремительным ростом количества вакцин (рис. 1).
Также в связи с этим интересен факт успешности исследований в той или иной сфере. Если среди исследований в онкологической сфере лишь 3,4 % оказываются успешными, у авторов вакцин гораздо больше шансов выйти на общий рынок: 33,4 % исследуемых продуктов подтверждают эффективность и безопасность. Это наилучший результат для всех терапевтических областей исследования (табл. 1)6.

Вероятность успешности клинического исследования по фазам и терапевтическим областям, %
Несмотря на все сложности, клинические исследования представляют собой самое острие современной медицинской науки и приоткрывают завесу будущего.
Пять глобальных трендов
Тренд 1. Рост числа клинических исследований
По данным международного сервиса «Статиста» (Statista), на 29 мая 2023 года в мире проводилось около 454 000 клинических исследований в различных фазах7. С высокой долей вероятности, по итогам будущего года это число дойдет до полумиллиона. Для сравнения: в 2002 году глобальный объем клинических исследований составлял 5270, а в 2010 году уже перевалил за 100 000. Еще через 5 лет (в 2015 году) число исследований удвоилось (рис. 2). Следующее удвоение произошло в 2021 году, за 6, а не за 5 лет, что можно объяснить некоторым снижением активности, связанным с пандемией.
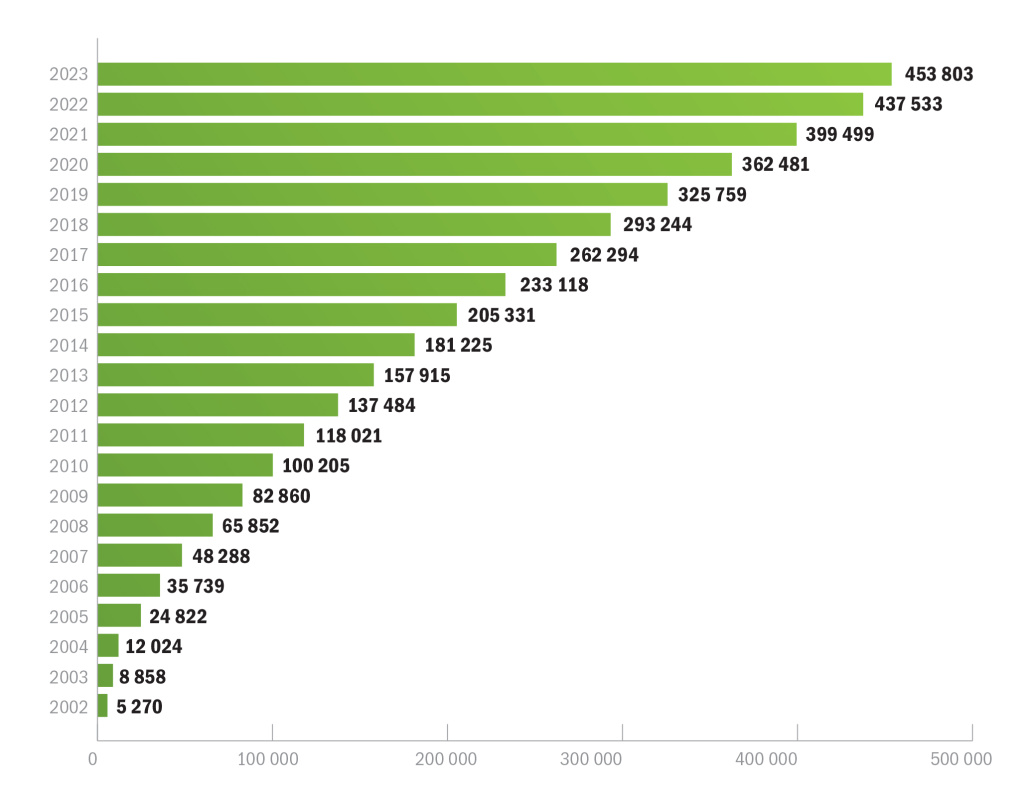
Рост числа клинических исследований в мире по годам, данные на 29 мая 2023 года, ед.
Совершенно очевидно, что такой рост связан с бурным развитием медицинской науки, компьютерных технологий, химических наук и фармацевтики. Освоение генетики, непрерывное расширение спектра биологических препаратов, инновации в сфере искусственного интеллекта и т. д. естественным образом ведут к стремительному росту числа клинических исследований во всех странах и на всех континентах.
На 14 ноября 2023 года количество клинических исследований в мире составляло уже свыше 473 0008.
Тренд 2. RWE, или постклинические исследования
Этот тренд отражает, с одной стороны, социальную ответственность производителей фармпрепаратов, которую возлагает на них современное общество, предъявляя достаточно высокие требования к прозрачности ценообразования и справедливости распределения готовых продуктов. С другой стороны, тренд обусловлен доступностью новых инструментов для проведения постклинических наблюдений. В первую очередь имеется в виду накопление больших данных из электронных медицинских записей и регистров, а также возможность их обработки с помощью специально обученных алгоритмов. Все это позволяет вести продолжительное наблюдение за пациентами, использующими те или иные препараты или технологии, и выявлять те свойства, которые нереально было определить в течение первых трех фаз клинического исследования. Каким бы масштабным оно ни было, воспроизвести все нюансы реальной практики в жестко регламентированных рамках не представляется возможным.
Но значение имеет не только углубление знаний о действии препарата в области изначального предназначения. Другой аспект постклинических исследований — выявление возможности применения препарата вне «зоны» исходного его исследования, то есть при других показаниях, офф-лейбл. Особое значение это имеет, в частности, в онкологической, педиатрической практике, при лечении редких и сложных заболеваний.
По данным ВОЗ на февраль 2022 года, 18 % зарегистрированных клинических исследований находятся именно на IV фазе9.
Тренд 3. Технологические инновации
Технологические инновации внедряются и в процессы проведения самих клинических исследований, что позволяет увеличивать их масштаб, скорость обработки и анализа получаемых данных. К подобным инновациям можно отнести телемедицинский контроль (там, где это возможно), сбор данных с носимых устройств, искусственный интеллект для оценки получаемых данных, чат-боты для сбора информации и взаимодействия с участниками исследования по рутинным вопросам. Это облегчает работу исследователей и делает более комфортным участие пациентов.
Биосимуляции отводится особое место в системе клинических исследований в будущем. Она позволит существенно ускорить начальные фазы.
БИОСИМУЛЯЦИИ ОТВОДИТСЯ ОСОБОЕ МЕСТО В СИСТЕМЕ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ В БУДУЩЕМ. ОНА ПОЗВОЛИТ СУЩЕСТВЕННО УСКОРИТЬ НАЧАЛЬНЫЕ ФАЗЫ
БИОСИМУЛЯЦИИ ОТВОДИТСЯ ОСОБОЕ МЕСТО В СИСТЕМЕ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ В БУДУЩЕМ. ОНА ПОЗВОЛИТ СУЩЕСТВЕННО УСКОРИТЬ НАЧАЛЬНЫЕ ФАЗЫ
Тренд 4. Пациентоориентированность и персонализация лечения
Персонализированная медицина, пациентоориентированность, ценностно-ориентированное здравоохранение в принципе являются трендами глобального развития здравоохранения и медицины. Подобные подходы отражаются и на сфере клинических исследований. Это проявляется в существенном интересе к генетическим технологиям. Но не только. Происходит принципиальный пересмотр отношения к пациенту, к персональной ценности терапии, к результатам лечения, важным для пациента с точки зрения не только его здоровья, объективных клинических данных, но и качества жизни, субъективной оценки собственного состояния. Участники исследования становятся в определенном смысле «соисследователями», помощниками клиницистов. Требования к коммуникации повышаются, и сама она становится продуктивнее.
Тренд 5. Сложность
Внедрение в практику сложных технологий, сложных препаратов, стремление как можно глубже изучить действие новых препаратов и инструментов диктует и более сложные условия для проведения клинических исследований. Это выражается в усложнении общего дизайна исследований, предельной детализации протоколов, условий отбора участников и их наблюдения. Если в 2001–2005 годах насчитывался в среднем 31 критерий отбора, то в 2011–2015 годах этих критериев стало уже 50. На 70 % возрос объем процедур в ходе клинического исследования за этот же период, на 86 % — количество клинических конечных точек (исходов), изучаемых в исследовании, на 88 % — число фиксируемых и анализируемых параметров в ходе каждого отдельного клинического исследования10. Согласно опросу, проведенному в 2022 году международной консалтинговой компанией Bain & Company среди сотрудников клинических исследовательских центров, 56 % респондентов согласились, что за последние три года клинические исследования существенно усложнились.
В определенной мере эта сложность обусловлена одним из перечисленных трендов — увеличением потребности в исследованиях, стремлением максимально углубить персонализацию и детализацию в ходе исследования. Но дальнейшее внедрение цифровых технологий в практику клинических исследований, опора на анализ реальной клинической практики и его совершенствование с помощью тех же технологий — все это решения для совершенствования сферы клинических исследований сегодня и в будущем. Причем ближайшем.
Литература:
-
Книга Пророка Даниила. Гл. 1, 11–15.
-
Hooper R. Lexicon Medicum; or Medical Dictionary. — NY: J.& J. Harper. — 1833.
-
Bhatt A. Evolution of Clinical Research: A History Before and Beyond James Lind // Perspect Clin Res. 2010 Jan-Mar; 1(1): 6–10.
-
Хельсинкская декларация Всемирной медицинской ассоциации. — URL: http://acto-russia.org/index.php?option=com_content&task=view&id=21
-
Number of clinical trial registrations by location, disease, phase of development, age and sex of trial participants (1999-2022). — URL: https://www.who.int/observatories/global-observatory-on-health-research-and-development/monitoring/n...
-
Berezow A. Clinical Trial Success Rates By Phase And Therapeutic Area. — American Council on Science and Health/ — URL: https://www.acsh.org/news/2020/06/11/clinical-trial-success-rates-phase-and-therapeutic-area-14845
-
Total number of registered clinical studies worldwide since 2000 (as of May 2023). — URL: https://www.statista.com/statistics/732997/number-of-registered-clinical-studies-worldwide/
-
Clinical Trials.gov.
-
Number of clinical trial registrations by location, disease, phase of development, age and sex of trial participants (1999-2022). — URL: https://www.who.int/observatories/global-observatory-on-health-research-and-development/monitoring/number-of-trial-registrations-by-year-location-disease-and-phase-of-development
-
Mikulic M. Increase in clinical trials' complexity 2001–2015. — URL: https://www.statista.com/statistics/732558/complexity-of-clinical-trials-increase/