Разработка лекарственных средств в мире не останавливается ни на минуту. Идет активный поиск новых молекул для лечения тяжелых генетических, онкологических, ревматологических, аутоиммунных заболеваний. Фармакологи не оставляют без внимания и относительно легкие заболевания: на смену давно применяемым лекарствам приходят более эффективные и безопасные препараты нового поколения. Доказательства их эффективности и безопасности собираются при помощи международных мультицентровых исследований.
Гармонизация правил надлежащей клинической практики — необходимое условие
Производство и применение лекарственных средств находятся под строгим государственным контролем. Изучение эффективности и безопасности новых лекарственных средств должно проводиться стандартизованно и беспристрастно, выводы должны основываться на объективных наблюдениях, а сама процедура клинического исследования должна носить гуманный и этичный характер, чтобы права и интересы субъектов клинического исследования (добровольцев, пациентов) были надежно защищены. В 1960-х годах законы, устанавливающие обязательный государственный контроль над исследованиями и продажей лекарственных препаратов, были приняты в США и во многих странах Европы. На основании национальных требований к качеству лекарственных препаратов и принципов Хельсинкской декларации Всемирной медицинской ассоциации (ВМА) сформировались и были закреплены в виде законов правила проведения клинических исследований (первая редакция Хельсинкской декларации ВМА появилась в 1964 году). Эти правила получили название Good Clinical Practice (GCP, Надлежащая клиническая практика)1.
Наличие в разных странах собственных правил носило негативный характер. Для принятия в каждой стране решения о регистрации препарата и выдачи разрешения на его медицинское применение должны были проводиться клинические исследования эффективности и безопасности в соответствии с национальными требованиями. Это приводило к тому, что производители лекарств должны были повторять одни и те же клинические исследования во многих странах, адаптировав их под законы определенной страны, что значительно увеличивало финансовые и временные затраты на вывод нового препарата на рынок. По этой причине больные получали современное эффективное лекарство иногда с задержкой на год или два. Поэтому в мире начался процесс гармонизации и сближения законов, регулирующих порядок проведения научных исследований лекарств.
В 1996 году международная экспертная рабочая группа подготовила документ «Международные гармонизированные трехсторонние правила надлежащей клинической практики» (ICH Harmonised Tripartide Guideline for Good Clinical Practice, сокращенно ICH GCP) и обратилась с призывом ко всем участникам процесса гармонизации придать ему силу закона в разных странах. В 1997 году правила ICH GCP начали действовать в США, Европейском союзе и Японии. Процесс работы над ICH GCP продолжается — в 1997 и 2000 годах были проведены еще две конференции по гармонизации, в 2000 году основные положения ICH GCP были зафиксированы в Директиве Европейского союза, имеющей силу закона в странах Европы.
Со времени разработки первого руководства ICH GCP масштаб, сложность и стоимость клинических исследований значительно возросли. Эволюция в технологиях и управлении рисками открывает новые возможности по увеличению эффективности клинических исследований и позволяет фокусироваться на наиболее значимых аспектах. Поэтому правила ICH GCP продолжают обновляться и дополняться.
ДАЖЕ В ПЕРИОД ПАНДЕМИИ КОВИДА В 2020 ГОДУ ЧИСЛО НОВЫХ МЕЖДУНАРОДНЫХ МНОГОЦЕНТРОВЫХ ИССЛЕДОВАНИЙ В РОССИИ НЕ ТОЛЬКО НЕ СОКРАТИЛОСЬ, НО И НЕСКОЛЬКО ВЫРОСЛО ПО СРАВНЕНИЮ С ПРЕДЫДУЩИМИ ГОДАМИ
Утвержденный приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 г. № 232-ст национальный стандарт Российской Федерации «Надлежащая клиническая практика» (ГОСТ Р 52379-2005) представляет собой почти дословный перевод Руководства по надлежащей клинической практике (Consolidated Guideline for Good Clinical Practice) Международной конференции по гармонизации технических требований к регистрации фармацевтических продуктов, предназначенных для применения человеком (International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use; ICH).
Зачем проводятся многоцентровые клинические исследования
Международная коллаборация на сегодняшний день является необходимым условием поиска инновационных средств как для лечения тяжелых заболеваний в области онкологии, гематологии, неврологии, так и для разработки более эффективных и безопасных лекарств нового поколения для лечения давно известных и хорошо изученных заболеваний. Основным направлением международного сотрудничества в области доказательства эффективности инновационных лекарственных препаратов и средств новых поколений можно считать международные многоцентровые клинические исследования (ММКИ). Различающиеся по фазам, дизайну и методам проведения они все должны отвечать международным требованиям ICH GCP и Хельсинкской декларации в отношении защиты прав и свобод субъектов исследования, научной ценности и отсутствия конфликтов интересов в процессе проведения исследования.
Зачем же нужны ММКИ, чем они отличаются от обычных клинических исследований, каковы особенности их организации и проведения в России? Согласно Федеральному закону от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» отчеты о клиническом исследовании, проведенном в форме ММКИ, принимаются в целях государственной регистрации лекарственных препаратов, если один из центров находится на территории России. Вот одна из причин включения России в ММКИ. Однако не все так просто. В соответствии с федеральным законом две экспертные организации принимают решение о возможности проведения клинического исследования в РФ: Совет по этике и ФГБУ «Научный центр экспертизы средств медицинского применения». Из-за сложности, длительности и многоэтапности рассмотрения документов в регуляторных органах наши клинические центры позже всех вступают в международное исследование.
МЫ ОСТАЕМСЯ ИНТЕРЕСНОЙ СТРАНОЙ ДЛЯ МИРОВЫХ ФАРМПРОИЗВОДИТЕЛЕЙ С НАШИМ БОЛЬШИМ ПОТЕНЦИАЛОМ И РЫНКОМ ДЛЯ ПРОВЕДЕНИЯ МЕЖДУНАРОДНЫХ МНОГОЦЕНТРОВЫХ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
По заверениям многих зарубежных компаний и сотрудников контрактных исследовательских организаций, желающих провести клинические исследования в России, длительность рассмотрения, отсутствие возможности до подачи документов провести консультацию с ключевыми специалистами экспертной организации на предмет качества клинических исследований приводит к длительным срокам получения разрешения на их проведение. Но, несмотря на все особенности отечественной системы допуска к ММКИ зарубежных фармацевтических компаний, компании заходят на российский рынок клинических исследований.
Каковы же цели зарубежных фармацевтических компаний на нашем рынке, зачем им включать РФ в свои клинические исследования, учитывая сложность и полную закрытость получения разрешения для этих исследований на территории РФ?
• Облегчение регистрации препарата зарубежной компании в будущем. Получение данных в свои итоговые отчеты, которые можно представить в пакете документов при регистрации в РФ своего нового препарата, учитывая, что ММКИ, как правило, проводится в РФ в третьей фазе.
• Быстрый набор субъектов исследования. В России занимаются набором сами исследователи (врачи), у них есть доступ и возможность формировать группы пациентов под необходимые исследования. Сами пациенты часто согласны участвовать в исследовании, если есть возможность получить более современную диагностику и помощь, за которую не надо платить. Это дает возможность более быстрого и качественного набора пациентов. Пациенты охотно идут в исследования, даже если есть какой-либо дискомфорт для их обычной жизни — следование определенному графику, изменение рациона или других параметров. Они понимают, что появляется доступ к новым лекарствам, более качественному персональному наблюдению врачом.
• Получение и анализ более обширных данных с одной территории (европеоиды, азиаты и т. д). Территория РФ занимает 1/6 часть суши, и ее населяет большое сообщество национальностей и рас. Данные, собранные в различных уголках территории, могут быть полезны и быстрее обработаны, нежели при проведении отдельных исследований в азиатском, европейском, африканском и других регионах.
Международные многоцентровые клинические исследования в России
Здесь мы рассмотрим динамику и объем рынка ММКИ в России в период с «доковидного» 2018 года и до III квартала 2023 года. В этот период происходили такие события, как пандемия ковида, начало специальной военной операции на Украине, которые не могли не отразиться на сфере клинических исследований лекарств, и особенно на проведении ММКИ. Поэтому мы провели анализ объема и динамики рынка ММКИ, зарегистрированных на территории РФ. Рынок международных клинических исследований в РФ демонстрировал относительную стабильность в 2018–2019 годах, и даже в период пандемии ковида в 2020 году число новых международных многоцентровых исследований не только не сократилось, но и несколько выросло по сравнению с предыдущими годами. Если рассматривать период с 2018 по 2021 год, то наблюдался ежегодный рост их числа. За 4 года он составил более 25 %. Однако в 2022 году в связи с геополитической напряженностью рынок ММКИ в России резко сократился, и в 2023 году мы продолжаем наблюдать его падение (рис. 1).
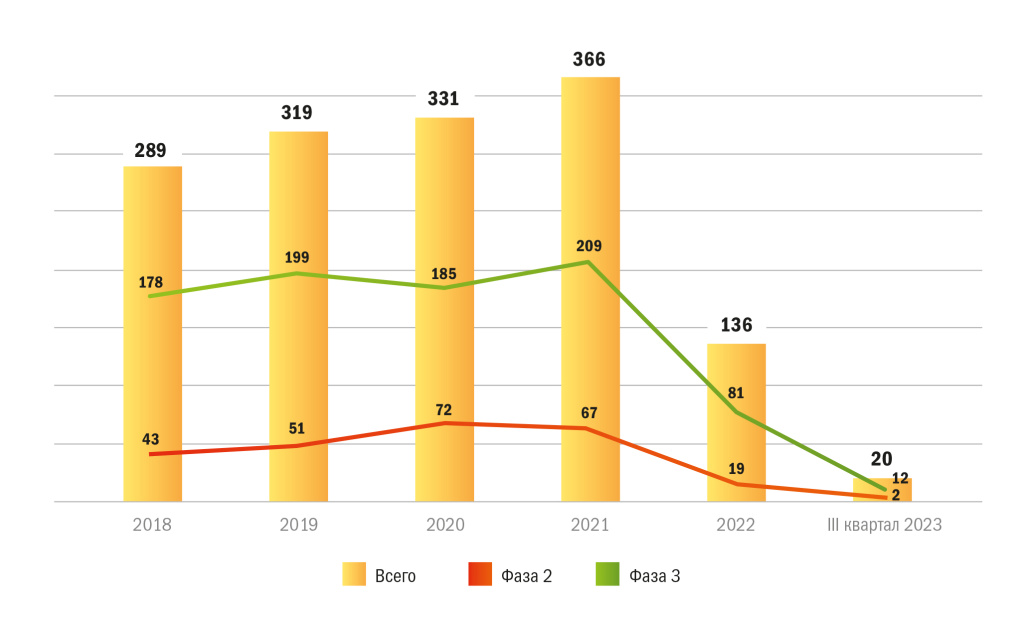
Рисунок 1 | Динамика рынка ММКИ в зависимости от фазы, 2018 г. — III кв. 2023 г., ед.
Крупные международные фармацевтические компании, включая AbbVie, MSD, Pfizer, Eli Lilly, Sanofi, Roche и GSK, весной 2022 года объявили о приостановке новых клинических испытаний в России и прекращении набора пациентов на текущие исследования после начала специальной военной операции на Украине. Общее количество выданных за 2022 год разрешений на проведение клинических исследований в России снизилось на 18,5 % и составило 740 против 908 в 2021 году2. Наиболее резким стало сокращение числа разрешений на ММКИ, на 63 % (136 против 366 в 2021 году).
По мнению экспертов, крупные фармкомпании потеряли много пациентов, участвующих в клинических исследованиях, причем сразу на двух рынках — России и Украины. Ассоциация организаций по клиническим исследованиям (АОКИ) со ссылкой на портал clinicaltrials.gov приводит данные, что на 21 июня 2022 года в России насчитывалось 1414 активных интервенционных клинических исследований, на Украине — 611.
Ряд компаний — организаторов ММКИ заявили об отказе от новых клинических исследований в нашей стране и прекращении набора новых пациентов в действующие ММКИ. Это было связано с логистическими сложностями, которые могут помешать проведению ММКИ в надлежащем формате и в установленные сроки. Несоблюдение стандартов обработки информации и валидации полученных результатов в централизованных лабораториях в рамках требований, которые установлены протоколом конкретного исследования, ставит под угрозу здоровье пациентов и ценность полученных данных. Как считают эксперты АОКИ, решение о приостановке клинических исследований было скорее даже не политическим, а рациональным, так как в нестабильной ситуации проводить исследования, которые длятся 5–10 лет, рискованно.
В 1-м полугодии 2023 года число разрешений на ММКИ сократилось более чем на 85 %: 16 против 113 разрешений годом ранее. Минимум одно из одобренных исследований, по данным АОКИ, спонсор уже не планирует запускать в России, еще четыре представляют собой так называемые продолженные исследования, в которые приглашаются лишь участники ранее завершившихся протоколов. Итого за полтора года доля ММКИ в общей структуре рынка снизилась с 40 до 2,4 %3.
На рисунке 2 представлено распределение ММКИ, получивших разрешение Минздрава России на проведение на территории РФ с начала 2018 года по III квартал 2023 года, по фазам проведения исследования.
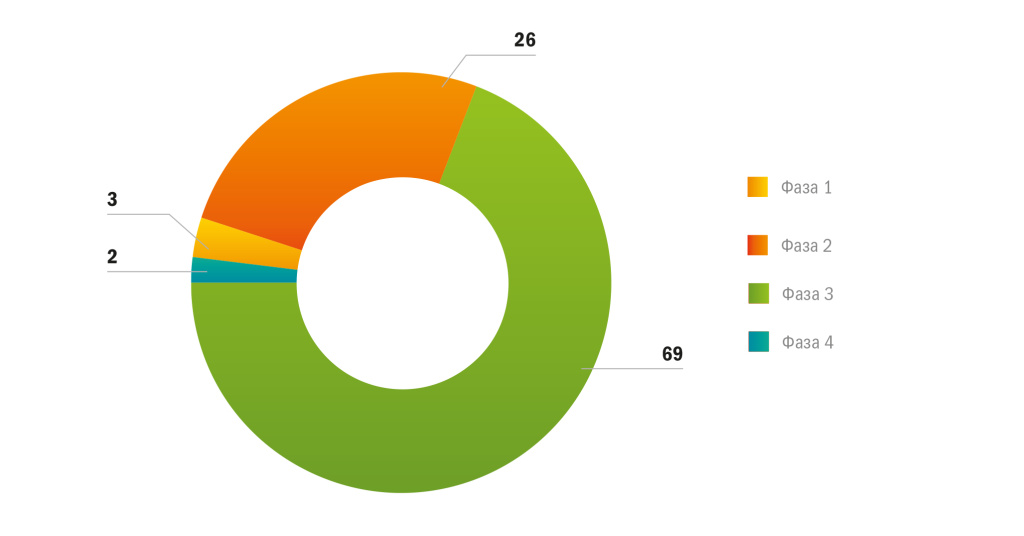
Рисунок 2 |Распределение ММКИ по фазам, 2018 г. — III кв. 2023 г., %
Из рисунка видно, что основную долю составляют исследования фазы 1 (почти 70 %), это так называемые регистрационные исследования. Много проводилось ММКИ фазы 2 (26 %). Среднее количество пациентов, получающих лечение в рамках исследований фазы 3 в РФ, составляет 150 человек (доверительный интервал p = 0,05 120–180), а исследований фазы 2 — 40–50 пациентов с определенной патологией.
Для анализа динамики изменений числа ММКИ с учетом фазы клинического исследования были взяты общие количества зарегистрированных ММКИ и отдельно исследования фазы 2 и 3 как составляющие основную долю (95 % от общего числа разрешенных клинических исследований). На диаграмме (см. рис. 1) видно, что исследования фазы 3 на протяжении последних пяти лет составляют примерно одинаковую долю ММКИ, так же как и исследования фазы 2.
В каких же терапевтических областях преимущественно проводятся ММКИ в нашей стране?
Как видно из рисунка 3, на первом месте онкологические исследования — 36 %, на втором — гематология (13 %), на третьем месте неврология (11 %). В 2020–2021 годах по причинам, связанным с пандемией COVID-19, наблюдался рост доли нозологии «инфекционные болезни» в общем количестве выданных разрешений на проведение клинических исследований, но на распределение ММКИ по нозологиям это повлияло незначительно.
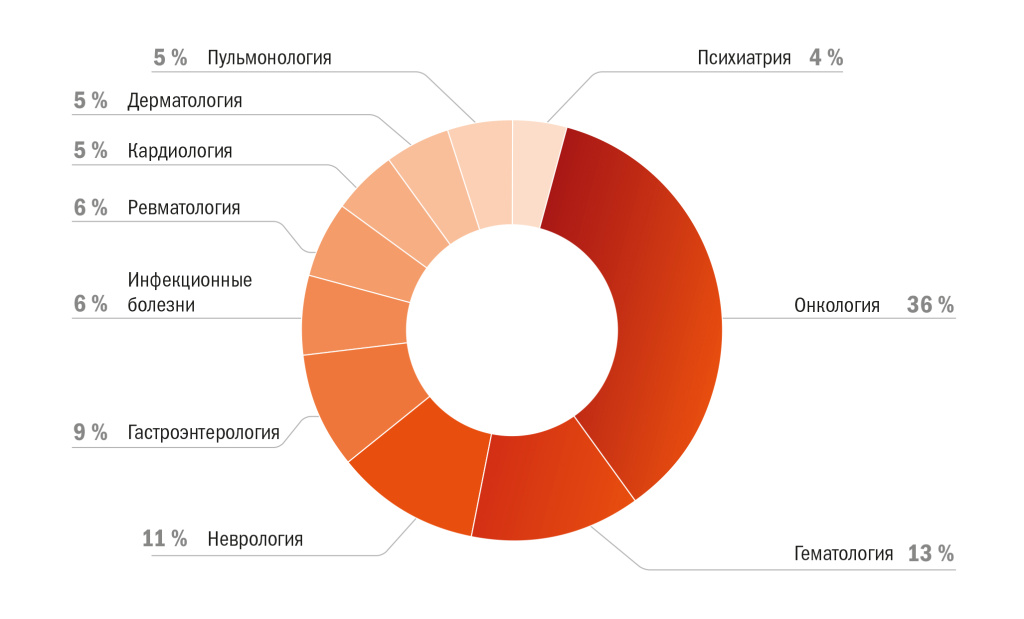
Рисунок 3 | Распределение ММКИ по нозологиям, 2018 г. — III кв. 2023 г.
На рисунке 4 отражена динамика изменения числа ММКИ в зависимости от нозологий на протяжении 5 лет. Структура распределения этих исследований по нозологиям оставалась практически без изменений.
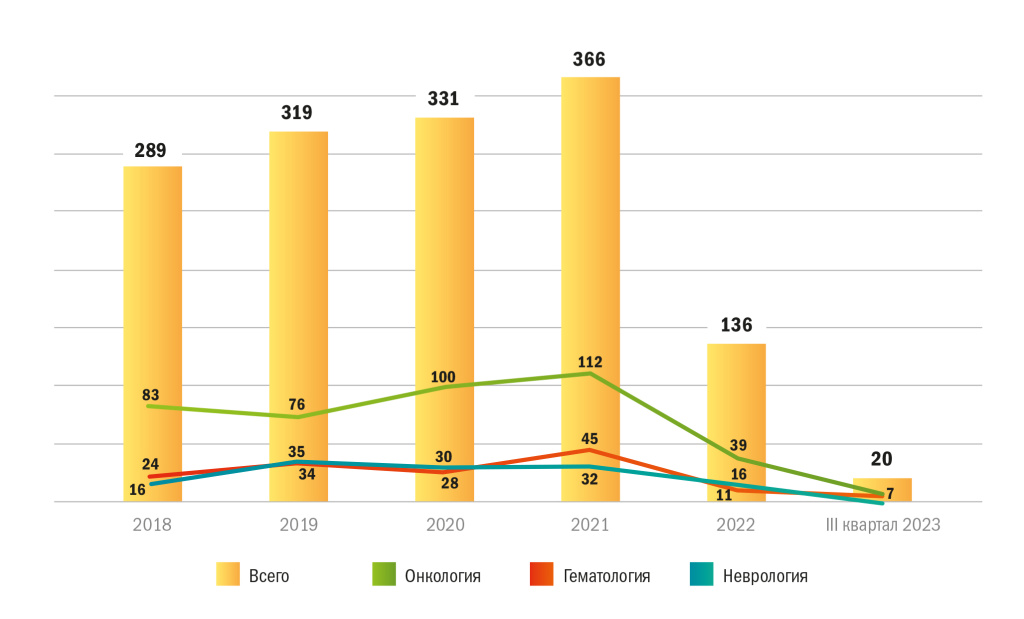
Рисунок 4 | Распределение рынка ММКИ по нозологиям, 2018 г. — III кв. 2023 г., ед.
Далее рассмотрим, производители лекарственных препаратов из каких стран доминируют на рынке ММКИ в России на протяжении последних 5–6 лет. На рисунке 5 приведено распределение ММКИ по странам-спонсорам.
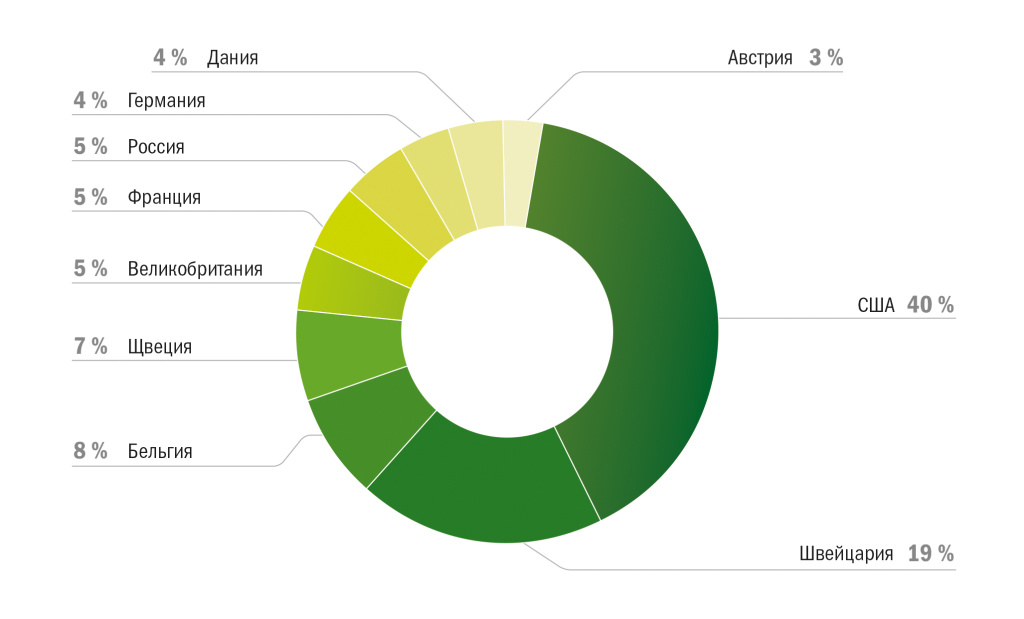
Рисунок 5 | Распределение ММКИ по странам-спонсорам, 2018 г. — III кв. 2023 г.
Среди зарубежных спонсоров ММКИ заметно преобладают США (40 %), значительную долю составляют исследования швейцарских компаний (19 %), на третьем месте Бельгия с 8 %, на 4-м месте Швеция с 7 %. Доли остальных стран, указанных в диаграмме, в числе которых и Россия, составляют по 5 % и менее.
На рисунке 6 отражена динамика рынка ММКИ в России с учетом трех ведущих иностранных участников-спонсоров. Видно, что на протяжении 2018–2021 годов в среднем распределение между основными игроками не изменялось. Начиная с 2022 года наблюдается рост доли российских спонсоров ММКИ на фоне ухода с рынка основных зарубежных участников.
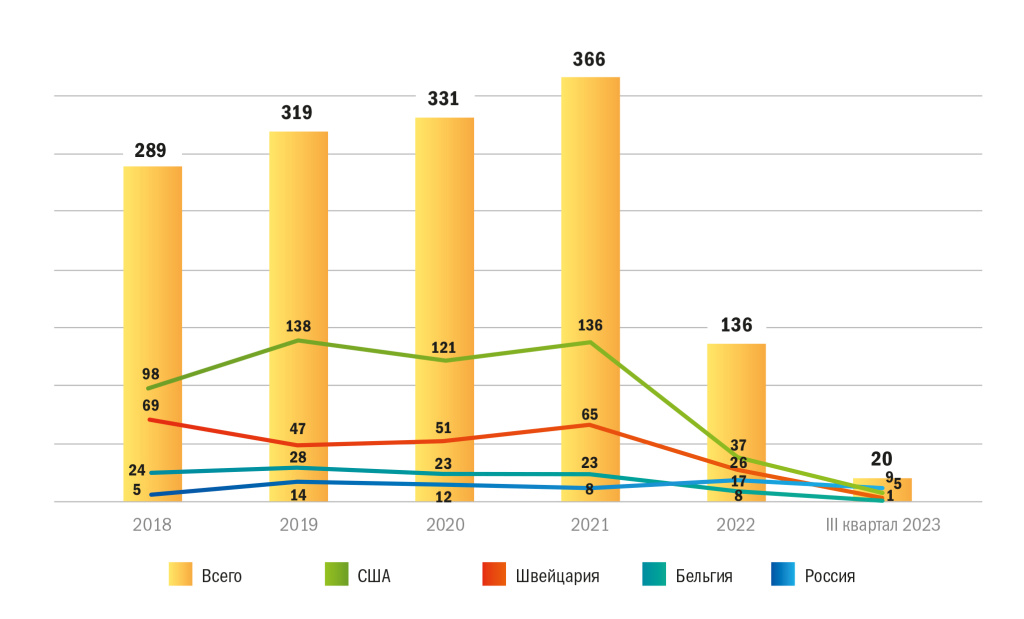
Рисунок 6 | Распределение рынка ММКИ по странам-участницам, 2018 г. — III кв. 2023 г., ед.
Анализ основных участников рынка ММКИ привлек внимание к существенному сокращению числа иностранных игроков в 2022 году. Так, по данным АОКИ, число спонсоров ММКИ составило 58 против 115 в 2021 году, а число привлекаемых к их проведению контрактных исследовательских организаций — 19 против 31.
В таблице 1 приведен топ-10 фармацевтических компаний — спонсоров ММКИ в России, составленный по числу проводящихся (текущих) исследований на конец III квартала 2023 года по данным Минздрава России (grls.rosminzdrav.ru).
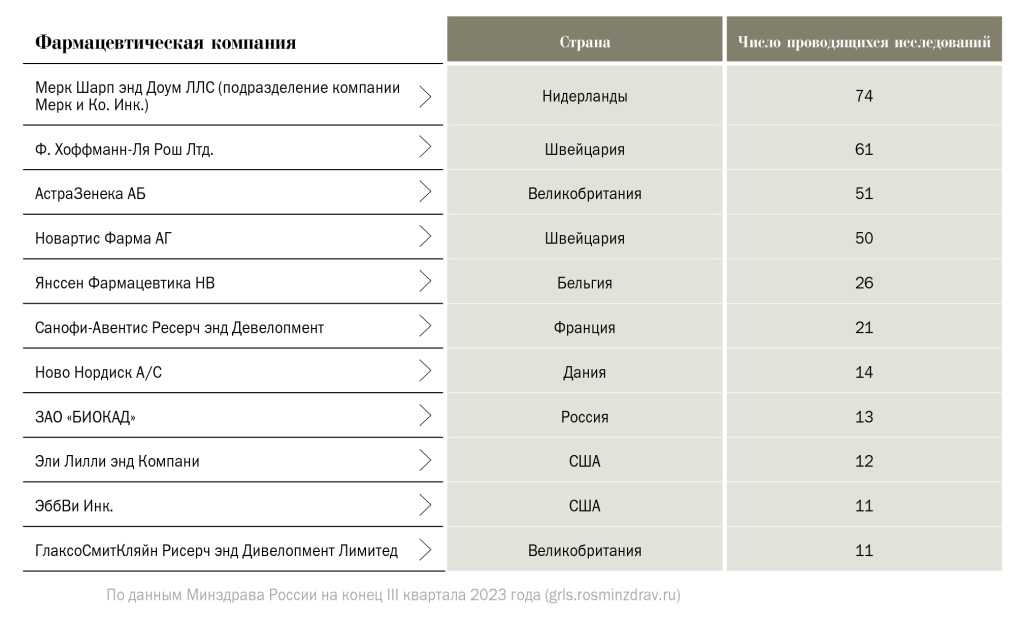
Топ-10 фармацевтических компаний, проводящих ММКИ на конец III квартала 2023 года
Исходя из общего анализа обозреваемой темы, в Россию будет продолжать идти поток ММКИ, но он будет не так обширен и разнообразен, как мы видели в 2018–2021 годах и как нам хотелось бы. Для этого есть как положительные, так и негативные причины. Мы остаемся интересной страной для мировых фармпроизводителей с нашим большим потенциалом и рынком для проведения ММКИ, но в силу геополитической нестабильности, недостаточной прозрачности и зарегулированности системы оборота лекарственных средств многие наши плюсы нивелируются.
Хочется выразить надежду, что в случае продолжительной паузы с инициацией новых ММКИ со стороны западных фармкомпаний их ниши начнут занимать производители из Индии, Южной Кореи и Китая, а также активизируются российские фармпроизводители.


